La Plataforma para el Estudio de la Conducta (PEC) es una acción estratégica emprendida por el IN para responder a uno de los mayores desafíos actuales en la neurociencia: entender cómo comportamientos animales normales o en condiciones patológicas emergen de la función de circuitos neuronales interconectados.
 Dentro de la PEC los animales se estabulan en racks ventilados lo que minimiza el ruido y estrés ambiental, aumentando el bienestar de los roedores y la eficiencia y reproducibilidad de los experimentos. Además, la estabulación en jaulas de enriquecimiento también esta disponible.
Dentro de la PEC los animales se estabulan en racks ventilados lo que minimiza el ruido y estrés ambiental, aumentando el bienestar de los roedores y la eficiencia y reproducibilidad de los experimentos. Además, la estabulación en jaulas de enriquecimiento también esta disponible.
La PEC posee siete salas, ubicadas en el animalario (RMG), diversamente equipadas, permitiendo al usuari@ desde la caracterización conductual básica de líneas mutantes y wild types, hasta la evaluación de aspectos concretos del comportamiento social, ansiedad y depresión, sueño, aprendizaje y memoria, o habilidades motoras. El equipamiento disponible incluye video tracking Smart V3, Erasmusladder, Morris water maze, Phenotyper, Touch-screen, Cold/Heat plate, Treadmills y cajas operantes para el miedo condicionado, entre otros. Además, existen otras cuatro salas disponibles fuera del RMG, 1 en el sótano y 3 en la segunda planta, donde cada usuari@ puede utilizar su propio equipamiento para llevar a cabo los estudios de comportamiento animal que precise.
SERVICIOS:
- Asistencia técnica para la utilización de los equipos y software disponibles en el servicio.
- Asistencia en el análisis y procesamiento de los datos adquiridos.
- Asesoramiento en la elección y/o diseño de la prueba de comportamiento que más se adapte a las necesidades del usuari@.
- Mantenimiento y gestión de reparaciones de los equipos.
- Elaboración de manuales y asistencia en la redacción de materiales y métodos para publicaciones.
- Organización y difusión de cursos de especialización en comportamiento y workshops sobre nuevos equipos o test disponibles.
- Valoración y asesoramiento en la adquisición de nuevo equipamiento.
- Participación en actividades de divulgación.
Las comunicaciones del servicio se llevarán a cabo a través de lista de distribución: in.pec@listas.umh.es
Las consultas se realizarán preferentemente por correo electrónico a: in.pec@umh.es
Behavioral tests available in the facility:
Learning and memory
- Novel object recognition (NOR)
- Novel object location (NOL)
- Fear conditioning
- Barnes Maze
- Morris water maze
- Y maze
- T maze
- Touch screen
Anxiety, stress and repetitive behavior
- Elevated plus maze
- Light-dark box
- Open field
- Zero maze
- Marble burying
- Nestlet shredding
- Forced swimming test
- Tail suspension test
Sensorimotor
- Cylinder test
- Balance Beam
- Grip Strength
- Wire hang test
- Hot/cold plate
- Olfactory test
- Open field
- Phenotyper
- Treadmill 2 & 5 lines
- Rotarod
- Erasmus Ladder
- qOMR
Social interaction
- 3-Chamber
- Tube dominance
- Intruder test dominance
- Ultrasonic vocalization
- Olfactory habituation and dishabituation
REQUISITOS DE ACCESO
1.- Se ha de recibir formación específica en materia de bioseguridad. Dicha formación será impartida por el personal del animalario previa solicitud en el correo g.moreno@umh.es.
2.- Es imprescindible disponer de la acreditación de la función C (ECC/566/2015) para realizar procedimientos en las instalaciones de la PEC.
3.- Cada usuari@ debe darse de alta en: in.pec@listas.umh.es, a través de la web https://listas.umh.es/sympa/info/in.pec. Desde esta lista se realizarán las comunicaciones referentes a la PEC.
4.- El horario de acceso a las salas de la PEC es de 8:00 a 20:00. Para accesos fuera de este horario y/o durante el fin de semana es necesaria notificación previa a g.moreno@umh.es e in.pec@umh.es, así como, registrarse en conserjería.
5.- Para acceder y trabajar en la zona experimental del animalario es obligatorio desvestirse y usar la ropa específica de trabajo del animalario, así como mascarilla, gorro y guantes.
6.- Para trabajar en la sala 8 y las salas de la segunda planta es obligatorio el uso de guantes, calzas, gorro y bata de laboratorio.
7.- Está totalmente prohibido introducir en al animalario (salas 1 a 7) elementos del exterior, esto incluye papeles/libreta, bolígrafos, teléfono móvil, cascos, animales, etc.
8.- La plataforma para el estudio de la conducta posee tres áreas de trabajo con diferente nivel de seguridad biológica por lo tanto el flujo de trabajo debe cumplir las siguientes restricciones:
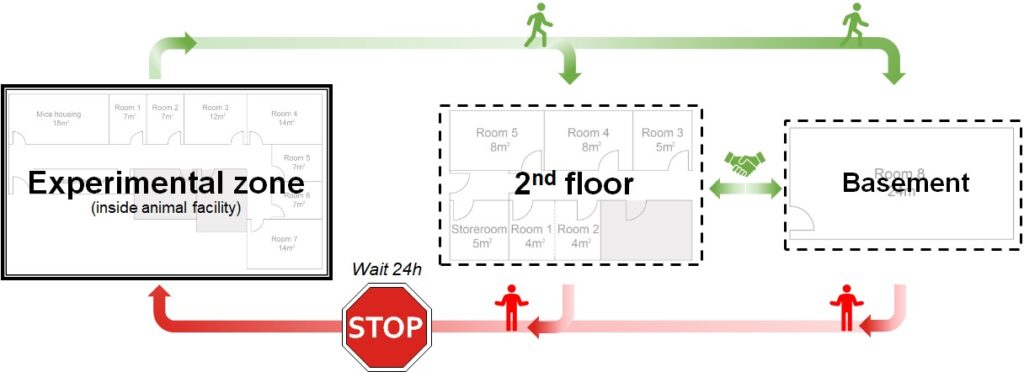
9.- No está permitido el uso simultáneo de la PEC y otro animalario (edificio Alberto Sols). Ante cualquier duda o necesidad específica en relación con esta norma contactar con g.moreno@umh.es e in.pec@umh.es.
10.- La ocultación de información conllevará la restricción de acceso a las instalaciones de la PEC, por lo tanto, ante cualquier duda o necesidad contactar con in.pec@umh.es.
NORMAS DE USO
Para utilizar las instalaciones de la PEC se ha de rellenar el formulario de uso y realizar la reserva pertinente a través de la página web del Instituto. Solo podrán llevarse a cabo procedimientos autorizados por la autoridad competente.
El titular de la reserva es el responsable de la misma y debe asegurarse de que tanto la habitación como el equipo estén en orden y limpios después de su uso. Además, en las salas de la segunda planta no se permite dejar equipamiento y/o utensilios propios de cada laboratorio sin autorización previa del personal técnico (solicitar a in.pec@umh.es).
El ruido puede afectar los resultados de las pruebas de comportamiento por lo tanto l@s usuari@s deben realizar los procedimientos con las puertas cerradas y evitar hablar en los pasillos.
Cuando se esté trabajando en la sala de comportamiento se ha de girar el cartel disponible en la puerta que indica “experiment in progress” y volver a girarlo una vez se abandone la sala.
No se permite alojar animales en las salas de comportamiento sin previa autorización del personal técnico. Para solicitar dicha autorización se ha de rellenar el formulario disponible para ello en esta web alojamiento temporal.
La habituación de los animales a la manipulación y a la sala de trabajo ha de hacerse dentro del horario reservado y en la sala reservada.
Normas específicas para las salas ubicadas dentro del RMG:
- Los equipos disponibles en salas 1, 2, 4, 5 y 6 son intransferibles. El resto de material y equipos de la PEC se guarda en el almacén o en la sala 2 y pueden trasladarse únicamente a las salas 2, 3 y 7 para su uso.
- Está prohibido cambiar la ubicación de los equipos asociados a una sala específica sin autorización previa del personal técnico (solicitar a in.pec@umh.es). Asimismo, se prohíbe la entrada o salida de equipamiento sin autorización previa.
- La configuración de las conexiones entre equipos y con la corriente eléctrica es fija y no puede modificarse. Si el/la usuari@ necesita conectar algún otro equipo, cada sala dispone de al menos un enchufe libre y/o una regleta. En caso de necesitar cambiar la configuración establecida solicite permiso a in.pec@umh.es.
- Cada sala está dotada de materiales de uso común que son intransferibles a otras salas (papel, ETOH 70%, elementos de papelería, etc.). Si alguno de estos elementos está próximo a terminarse o se ha extraviado, informe a in.pec@umh.es.
- Si el test de comportamiento no permite tener la jaula y el resto de animales en la sala durante el procedimiento (excesivo ruido, escaso espacio, …) no se permite la reserva de salas anexas para la manipulación y/o habituación de los animales. En este caso, los animales se trasladarán desde la sala de estabulación a la sala reservada directamente, pudiendo hacer la transferencia del animal seleccionado a una caja individual en la campana.
- Los archivos creados durante los experimentos deben transferirse electrónicamente a ordenadores externos (por correo electrónico, Google drive, Dropbox, etc.). Una vez que se haya comprobado la correcta recepción y funcionamiento de los archivos en el ordenador externo deben eliminarse de los ordenadores de la PEC.
- La conexión en remoto a los ordenadores de la PEC se permite siempre y cuando no haya una reserva en curso de la sala.
L@s usuari@s de la PEC son responsables de comprobar el correcto etiquetado de sus jaulas alojadas en la zona experimental y resonancia, así como de actualizar el código procedimental que aparece en la tarjeta si fuese necesario o añadirlo si no aparece.
Toda incidencia deberá notificarse por correo electrónico a in.pec@umh.es.
RESERVAS
Solo los usuarios dados de alta en la lista de distribución de la PEC (in.pec@listas.umh.es) podrán realizar reservas, siendo estas personales e intransferibles.
Las salas de la PEC se reservarán a través de la INTRANET, antes de su uso, en bloques de 2, 3 ó 6 horas en función de la sala seleccionada, hasta un máximo de cuatro semanas consecutivas. Sin embargo, aquellas reservas que ocupen completamente el horario de trabajo de una sala podrán tener una duración máxima de dos semanas consecutivas para las salas situadas dentro del RMG y de tres días consecutivos para el resto de salas. Para reservas que no se ajusten a la duración/requisitos indicados, contactar directamente con el personal técnico en: in.pec@umh.es
Una vez realizada la/-s reserva/-s a través de la intranet, el/la usuari@ debe completar el documento disponible en esta web: formulario de uso. Se podrán agrupar en un único formulario varias reservas de una misma sala siempre y cuando, se trate del mismo código procedimental y la misma cohorte. En caso de no rellenar dicho formulario, no se hará efectiva la reserva de la sala y, por lo tanto, el/la usuari@ no podrá hacer uso de las instalaciones y equipos de la PEC.
El horario de acceso y uso de las instalaciones de la PEC es de 8 a 20, de lunes a viernes. En caso de que se requiera acceso durante el fin de semana o pasadas las 20:00, será necesario notificar previamente a g.moreno@umh.es e in.pec@umh.es, así como registrarse en conserjería.
Para cualquier cambio o liberación de sala escribir a in.pec@listas.umh.es.
UBICACIÓN
La plataforma para el estudio de la conducta (PEC) está ubicada en el Instituto de Neurociencias (edificio Santiago Ramón y Cajal) y consta de una amplia zona de trabajo dentro del RMG, cuya equitación disponible es la siguiente:
- Room 1. ErasmusLadder and qOMR
- Room 2. Videotracking
- Room 3. Videotracking
- Room 4. Morris Water Maze
- Room 5. Fear conditioning and startle reflex boxes
- Room 6. Phenotyper
- Room 7. Videotracking
Además, tres salas multiusos están también disponibles para su uso en la segunda planta del IN, en las cuales se puede trabajar con luz blanca y/o luz roja. En esta área, las salas 1 y 2 pueden unirse para aquellos procedimientos que requieran un mayor espacio de trabajo.
Finalmente, la plataforma dispone también de una sala de gran tamaño situada en el sótano del edificio junto al servicio de imagen molecular (sala 8).

EQUIPO/CONTACTO
Responsable del animalario:
Gonzalo Moreno del Val – email: g.moreno@umh.es
Responsables científicos instalaciones PEC:
RMG/Sótano: Isabel Pérez Otaño – email: otano@umh.es
Planta 2: Felix Leroy – email: fleroy@umh.es
Las consultas específicas o relacionadas con las reservas e incidencias se deben realizar por correo electrónico a: in.pec@umh.es.
Las comunicaciones del servicio se llevarán a cabo a través de la lista de distribución de la UMH: in.pec@listas.umh.es.
Contacto:
Plataforma para el estudio de la conducta
Instituto de Neurociencias
Universidad Miguel Hernández – CSIC
Av. Santiago Ramón y Cajal s/n
03550 Sant Joan d’Alacant (Spain)
E-mail: in.pec@umh.es
Responsable científico / técnico: Juan Antonio Moreno
El alojamiento RMG del Instituto de Neurociencias es un lugar de barrera donde los ratones experimentales se mantienen en condiciones controladas de temperatura, humedad, ciclos de luz y SPF. Está dividido en dos zonas: una destinada a la cría y mantenimiento de los ratones y otra zona experimental con dos quirófanos y siete boxes de comportamiento. Los dos quirófanos están totalmente equipados con todo el material necesario para realizar manipulaciones cerebrales (electroporaciones, inyecciones de virus) y distintos procedimientos experimentales en ratones (cirugías, administración de fármacos, toma de muestras, pesaje, etc). En suma, estas salas cuentan con tres sistemas de anestesia por inhalación, dos UCI, endoscopios, básculas para pesar, microcentrífugas, fuentes de luz, placas calefactoras, dos nanoinyectores, un electroporador y un estereotáxico.


- Es obligatorio que los nuevos usuarios reciban la formación correspondiente por parte del personal de la Instalación antes de utilizar cualquiera de estos equipos.
- El área de trabajo debe mantenerse siempre limpia, especialmente después de finalizar la sesión.
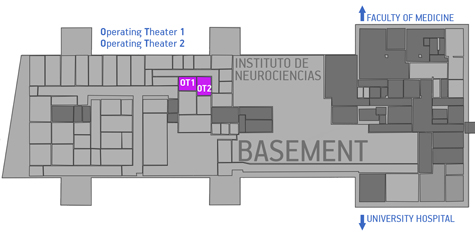
Este servicio está ubicado en el piso sótano del IN y está dividido en:
- Sala de operaciones 1
- Sala de operaciones 2
(texto en English)
Electroporator CUY21 SC. Nepa Gene
The CUY21 SC can measure the electric current from the low ampere (1mA) up to 1.60A. The CUY21 SC was developed for the electroporation of genetic constructs that are delivered into the sensitive target region such as mouse’s brain, tissue slices and embryos (chick, mouse). The CUY21 SC can be used with different NEPA GENE’s CUY series electrodes to perform a wide range of electroporation experiments. In our animal house there are the CUY650P3 and CUY650P5 Tweezers w/3mm or 5mm diameter platinum disk electrode (Nepa Gene Co., Ltd.)
Estereotaxic Stoelting 51730
Carry a basic stereotaxic frame, together with all the usual accessories. Precision alignment ensures accurate placement of electrodes, micropipettes, and other devices. Is ideal for researchers in need of a versatile, reliable instrument for stereotaxic procedures with mice and other small rodents.
Nano injector. NANOLITER 2010-WPI
The Nanoliter Injector offers significant options and controls ideal for ultra-delicate work with oocytes, embryos, and tissues. Injection volumes range between 2.3 nanoliters and 69.0 nanoliters in 16 selectable increments.
Vetario TS INTENSIVE CARE UNITS
 Designed for helping the recovery of mice after an experimental procedure. It avoids the hypothermia, shock and other complications derived from the experimental procedure performed.
Designed for helping the recovery of mice after an experimental procedure. It avoids the hypothermia, shock and other complications derived from the experimental procedure performed.
Responsable científico / técnico: Berta López
1. Para el uso de los equipos es necesaria la reserva a través de la intranet del sitio web del IN: sistema de reservas intranet
2.Para el equipo de anestesia común de isofluorano, se asigna un máximo de 16 horas por grupo de investigación en horarios restringidos (9.00 a 18.00 horas).
3. Fuera del horario de uso restringido, no existe restricción en la reserva de franjas horarias aunque éstas deberán ser siempre anotadas
4.La cancelación de reservas antes de un día se puede realizar a través de la página web. Las cancelaciones el mismo día que se reserva el equipo se deben hacer por correo electrónico a la lista de distribución in.personal para liberar el cupo.
5. El área de trabajo debe mantenerse limpia, particularmente después de finalizar la sesión.
6. Cualquier duda, contactad con el responsable del servicio.
7. Uso del equipo de anestesia:
-Los depósitos de isofluorano deben llenarse por completo (hasta la línea superior) una vez finalizados los procedimientos y cada vez que se utilice.
-Los usuarios deben llenar el “Registro de Uso de Isofluorano” con los datos requeridos (nombre, grupo y tiempo de uso) cada vez que se utiliza el equipo.
-Los registros de recarga de isofluorano deben actualizarse.
-Cerrar el tanque de O2 después de usar el equipo.
Este servicio está ubicado en la sala 105 (primer piso).


Este servicio está ubicado en la sala 105 (primer piso).
(texto en English)
Common surgery equipment:
Isofluorane and oxygen anesthesia system, Anesthesia induction chamber, Stereomicroscope and light source, Heating blancket, Minifugue for eppendorf tubes, Waterbath, Heating plate, Fluorescence Estereomicroscope Leica MZ16FA (GFP and DsRed filters).
Electroporator in vivo Cuy21Edit

CUY21EDIT(Electroporator) can introduce DNAs, siRNAs, drugs, into tissues including brain or embryos.
• General characteristics: -Voltage 1~500V -Pulse time 0.1~999.9ms -Pulse Interval 0.1~999.9ms -Pulse number 1~99 time(s) -Impedance measurement ~18kO -Effective voltage 1~500V -Effective current 0.01~4.00
•Aplications: In vivo, in utero, ex utero, in ovo, ex ovo, ex vivo electroporation.
Vevo 3100 micro Ultrasound Imaging System

Ultrasonic imaging system adapted for use in small animals including mouse and zebrafish. This system makes possible a high-resolution anatomical visualization to perform cardiovascular, renal, reproductive system, oncological or embryonic development studies in real time.
• General characteristics:
-Microinjector.
-Isofluorane anesthesia system.
-MX201 transducer: 10-22 MHz, Centre Transmit: 15 MHz, Axial Resolution: 100 µm.
-MX550D transducer: Centre Transmit: 40 MHz, Axial Resolution: 40 µm.
• Applications
Developmental biology:
-Gestation monitorization and determination of embryonic stage.
-Analysis of placental structure and function.
-Monitoring of organ development in the embryo.
-Injection of viruses, cells or drugs into intra-uterine embryos: in the brain, eye, spinal cord or any other developing organ..
Oncology:
-Tumor detection and tumour burden quantification.
-Visualization and quantification of tumour angiogenesis, vascularization and perfusion.
-Therapy responses (non invasive measure of tumors over time).
-Guided implantation of tumor cells.
-Precise injection of drugs into tumors.
-Ultrasound guided biopsy.
Abdominal analysis:
-Function of kidneys, liver and reproductive system.
Cardiovascular studies:
-Cardiac function in 2D, 3D or 4D
-Hemodynamics.
IVIS Lumina XR

Real-Time in vivo bioluminescence, fluorescence and X-Ray Imaging System for small animals.
• General characteristics:
– 10 filter sets to image reporters that emit from green to near-infrared (capable of imaging all common fluorescent and bioluminescent reporters).
– Heated stage to keep animals from becoming hypothermic.
– Input and output connection ports for the anesthesia system.
– X-ray. Precise optical and X-ray overlay allows you to bring your optical signal into.
• Applications:
The IVIS Lumina XR can be used in oncology research to follow tumor progression, monitor response to therapeutic treatments, metastasis, cell tracking, and tumor burden monitoring. Other uses include: infectious disease, inflammation studies, metabolic disease, neurology, gene therapy, stem cell biology, cardiovascular disease, immunology, transplantation biology, and drug metabolism studies.
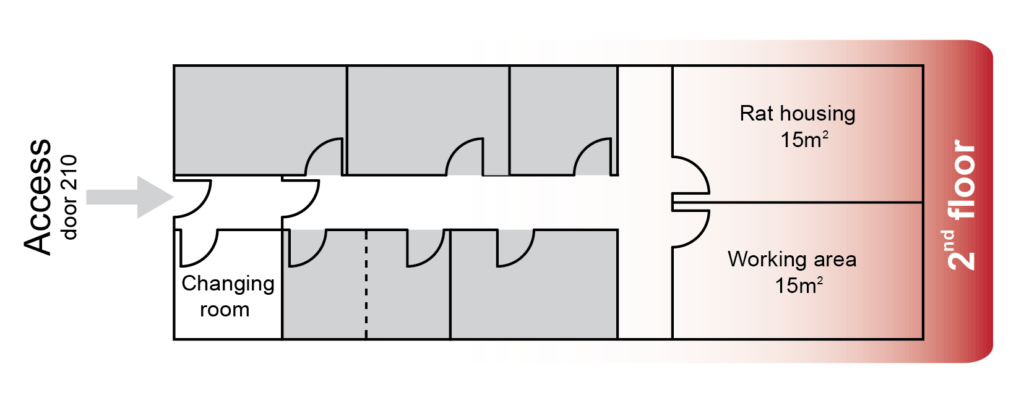
 En la segunda planta del Instituto de Neurociencias se encuentra el Área de Análisis del Comportamiento en Ratas, específicamente en la estancia 210. Esta zona cuenta con una habitación diseñada para el alojamiento de los animales (rat housing, ver mapa más abajo), equipada con racks ventilados que garantizan su bienestar.
En la segunda planta del Instituto de Neurociencias se encuentra el Área de Análisis del Comportamiento en Ratas, específicamente en la estancia 210. Esta zona cuenta con una habitación diseñada para el alojamiento de los animales (rat housing, ver mapa más abajo), equipada con racks ventilados que garantizan su bienestar.
Adicionalmente, se dispone de un espacio de trabajo (working area), que se divide en dos secciones distintas. Una destinada a realizar experimentos de conducta, y otra contigua desde la que el experimentador puede supervisar y/o controlar el experimento.
El equipamiento disponible en el área de trabajo incluye:
- Laberinto de campo abierto (open field maze)
- Laberinto de cruz elevada (plus maze)
- Cámara de alta resolución para el seguimiento de los movimientos
- Sistema de control automático de iluminación
- Rotarod diseñado específicamente para ratas
- Prueba de agarre (grip test)
Estas instalaciones proporcionan un entorno adecuado para realizar experimentos de comportamiento en ratas. Adicionalmente, equipos de registro electrofisiológico multicanal y de registro de calcio con fibra óptica, pueden integrarse en la zona de trabajo para realizar experimentos simultáneos de conducta y registro de la actividad cerebral (consultar con los responsables).
Estas instalaciones están diseñadas para operar en un ciclo de luz inverso controlado, y la iluminación disponible se basa en luz roja, cuya longitud de onda es óptima para llevar a cabo estudios de comportamiento en ratas. En la entrada de esta área, se encuentra un vestuario (changing room) que proporciona a los usuarios acceso a los equipos de protección individual necesarios. Esto garantiza la integridad sanitaria de los animales y minimiza cualquier interferencia en su conducta. La prioridad es mantener un entorno propicio para la investigación científica de alta calidad y el bienestar de los animales sujetos a estudio.
Requisitos de acceso
- 1. Para acceder al Área de Análisis del Comportamiento en Ratas (estancia 210), se ha de recibir formación específica en materia de bioseguridad. Dicha formación será impartida por el personal del animalario previa solicitud en el correo moreno@umh.es. Además, es imprescindible disponer de la acreditación de la función C (ECC/566/2015).
- 2. Los nuevos usuarios deben recibir también una introducción al código de conducta y normas de organización de esta área experimental por parte del personal de la instalación. Dicha formación se ha de solicitar al personal técnico en el correo electrónico: asanz@umh.es. Una vez recibida ambas capacitaciones, se activará la tarjeta para el acceso a las instalaciones de esta área (estancia 210).
- 3. Para acceder y trabajar en esta área es obligatorio desvestirse y usar la ropa específica de trabajo con ratas disponible en el vestuario de la entrada, así como mascarilla, gorro y guantes.
Normas para el uso del Área de Análisis del Comportamiento en Ratas
Para acceder al Área de Análisis del Comportamiento en Ratas, es imprescindible efectuar una reserva previa a través del correo electrónico: scanals@umh.es y asanz@umh.es. En la solicitud, se debe especificar la fecha, hora, tipo de prueba a realizar y el código procedimental correspondiente. Únicamente se permitirán procedimientos autorizados por la autoridad competente.
El responsable de la reserva deberá asumir la responsabilidad de mantener la habitación y el equipo en perfecto orden y limpieza después de su uso.
En esta área, se deben observar las siguientes pautas:
- Trabajar en un entorno de absoluto silencio.
- Está terminantemente prohibido utilizar teléfonos móviles dentro del área, especialmente en las habitaciones designadas. Los dispositivos móviles deben mantenerse en modo silencio durante la estancia en el área.
- Se deben utilizar exclusivamente la indumentaria y el calzado proporcionados para esta área. Estos se encuentran en el «vestuario» y son de color naranja, al igual que los zuecos que se pueden encontrar debajo de la poyata de la misma habitación.
- La ropa de calle debe colgarse detrás de la puerta.
- Todo material ingresado debe cumplir con los más rigurosos estándares de desinfección y limpieza.
Dado que los animales se encuentran en un ciclo inverso, se requiere prestar especial atención al uso de luces blancas en este espacio.
Cualquier incidencia debe ser notificada a través del correo electrónico a asanz@umh.es y/o scanals@umh.es
Responsable científico:
Santiago Canals Gamoneda – scanals@umh.es
Responsable técnico:
Aroa S Maroto – asanz@umh.es
Responsable científico: Sandra Jurado
Personal técnico: María Pérez
El servicio de cirugía ubicado en la sala 227 (2º piso) cuenta con un espacio dedicado y el equipamiento necesario para realizar intervenciones quirúrgicas en modelos animales murinos (ratas y ratones). El servicio se dedica principalmente a inyecciones intracraneales in vivo (inyecciones estereotáxicas) de partículas virales, pero también está disponible para inyecciones de células, fármacos, inyecciones intraperitoneales y microcirugías, entre otros procedimientos.
El servicio de cirugía ofrece los siguientes servicios:
- Sala equipada con mesa quirúrgica, estereoscopio y cámara de recuperación de animales con temperatura regulable
- Marco estereotáxico adaptable para ratones y ratas (Kopf) y accesorios
- Vaporizador de isoflurano
- Concentrador de oxígeno
La sala y el equipo se pueden reservar de forma independiente, ya que la mayoría de los equipos pueden ser retirados para realizar procedimientos en laboratorios individuales.
La reserva de la sala y el equipo debe realizarse a través de la intranet en:
acceso usuarios.
Hay que tener en cuenta que deben de hacerse reservas independientes para la sala (Cirugía) y el equipo requerido. Las opciones se enumeran a continuación:
- Cirugía
- Cirugía-concentrador de oxígeno
- Cirugía-Estereotáxico
- Cirugía-Isoflurano
Los nuevos usuarios deben ponerse en contacto con la Dra. Sandra Jurado: sjurado@umh.es para recibir una breve formación y familiarizarse con las pautas de uso. Este primer contacto es obligatorio para acceder al quirófano.
Para cualquier consulta o incidencia con la instalación, contactar con la Dra. Sandra Jurado: sjurado@umh.es.

 English
English