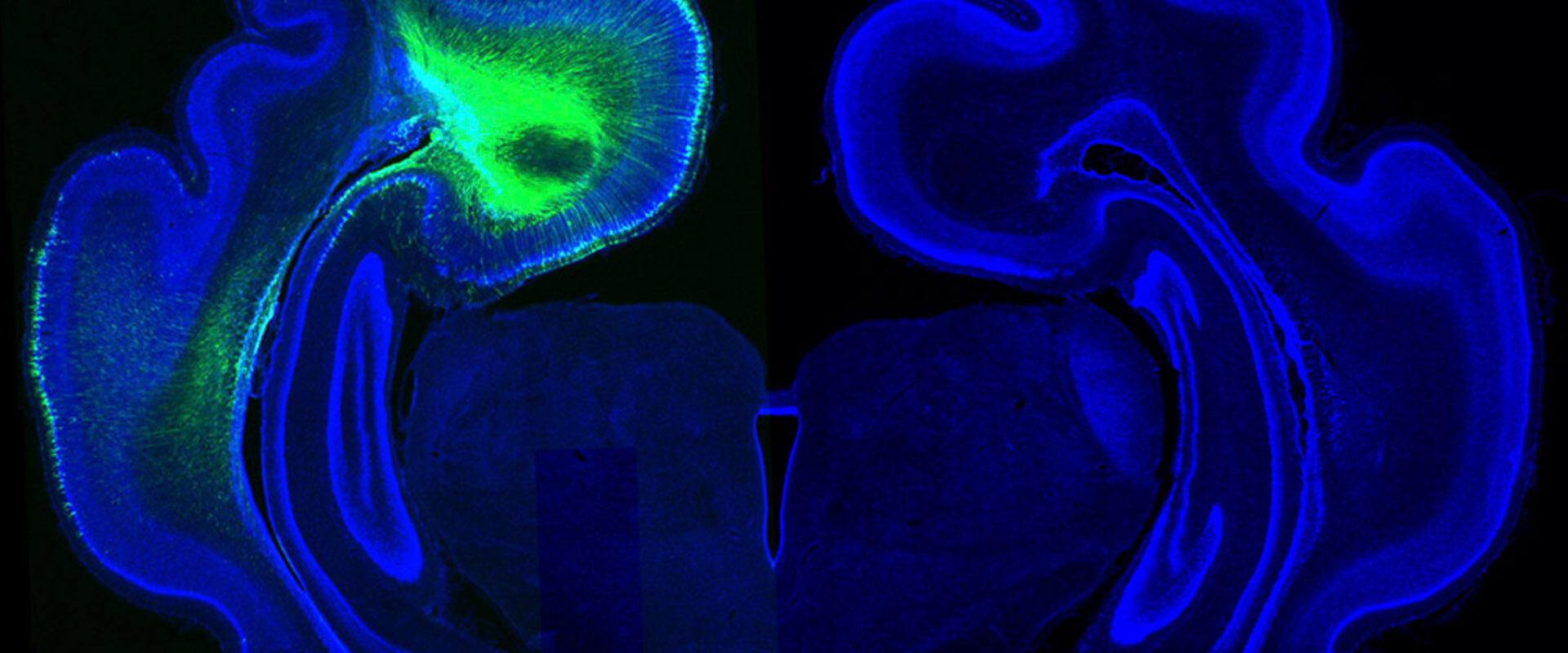
Gene regulatory landscape of cerebral cortex folding
Descubren el posible mecanismo que sienta las bases para que se produzcan pliegues en la corteza cerebral.
-Este trabajo muestra que las marcas epigenéticas son un mecanismo clave en las instrucciones que reciben los genes para expresarse y formar pliegues.
-La proteína Cux2 tiene la capacidad de alterar el patrón del plegamiento cerebral en hurones e inducirlo en ratones.
(Foto: Lucía del Valle Antón, Eduardo Fernández Ortuño, Víctor Borrell, Virginia Fernández, Rafael Soler y Adrián Cárdenas, investigadores del IN-CSIC-UMH)
Determinar los factores genéticos y epigenéticos que influyen en el plegamiento cerebral es el objetivo del último estudio coliderado por el laboratorio Neurogénesis y expansión cortical, que dirige el investigador Víctor Borrell en el Instituto de Neurociencias (IN), centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad Miguel Hernández (UMH) de Elche, y el laboratorio que lidera el investigador Vijay K. Tiwari en el Instituto Wellcome-Wolfson de Medicina Experimental de la Queen’s University de Belfast (Reino Unido). Este trabajo, publicado en la revista Science Advances, ha demostrado que las marcas epigenéticas son un mecanismo clave en las instrucciones que dan lugar a los pliegues de la corteza cerebral y que la proteína Cux2 juega un papel determinante en este proceso.
El equipo de Borrell ya había desarrollado un protomapa que establece a nivel genético donde se generarán los giros y los surcos en el cerebro durante una etapa del desarrollo embrionario en la que todavía no han comenzado a generarse los pliegues. “Al principio la corteza es lisa, pero hay una zonas que crecerán muchísimo y darán lugar a giros; mientras que al lado hay otras zonas que crecerán menos y quedarán hundidas, formando un surco”, explica el investigador y añade: “Esto se debe a que hay miles de genes que se expresan en la corteza del embrión mientras se está desarrollando, pero no lo hacen en la misma cantidad en todas las zonas”.
Gracias a la colaboración con el laboratorio de Tiwari, experto en análisis de epigenética y epigenómica, han podido llevar está investigación un paso más allá y estudiar lo que se conoce como paisaje epigenético de las células de la corteza cerebral: “Hemos estudiado mucho más que un gen concreto en un sitio particular, sino que hemos sido capaces de observar todo el ADN de la células y sus modificaciones epigenéticas, que determinan el comportamiento de estos genes, con el fin de entender los mecanismos que dan lugar a su expresión”, señala Borrell.
Para desarrollar este estudio, los investigadores se centraron en la marca epigenética H3K27ac, porque se trata del indicador con mayor capacidad para predecir de la expresión de genes. Sin embargo, los resultados fueron muy sorprendentes: “Observamos que en muchos lugares donde sí estaba presente H3K27ac no se producía la expresión de genes y también observamos el caso contrario, había genes que se expresaban sin que estuviera presente la marca epigenética”, comenta Lucía del Valle Antón, coprimera autora del artículo. Los expertos coinciden en que este hallazgo es un claro indicador de la complejidad del sistema nervioso: “En el campo de la epigenética encontramos evidencias que apuntan a que el sistema nervioso durante su desarrollo es una excepción y no funciona de la misma manera que el resto de tejidos que tenemos en el cuerpo. Sin duda hay un largo camino por estudiar y es un reto apasionante”, destaca Borrell.
Ese hallazgo inesperado les llevó a indagar en lo que sucedía en aquellos genes en los que sí había una coincidencia entre la marca H3K27ac y la expresión. Para ello se centraron en las proteínas que regulan directamente cuánto se expresan los genes, que se denominan factores de transcripción. Concretamente en la proteína Cux2 porque su participación en el desarrollo cerebral es ampliamente conocida.
Cux2, un factor maestro
Cux2 es una proteína involucrada en la diferenciación de las neuronas, en el crecimiento de sus dendritas y en la formación de circuitos neuronales en general. Los expertos quisieron verificar la influencia de este factor en el plegamiento del cerebro y para ello introdujeron ADN que codifica esta proteína dentro del cerebro del embrión durante su gestación. Gracias a esta técnica confirmaron que Cux2 es capaz de alterar los patrones: “Tiene la capacidad de formar pliegues en la corteza cerebral del ratón, que es lisa, y en el caso del hurón, que ya tiene pliegues, la proteína puede cambiar por completo el patrón establecido de esos pliegues”, explica del Valle Antón.
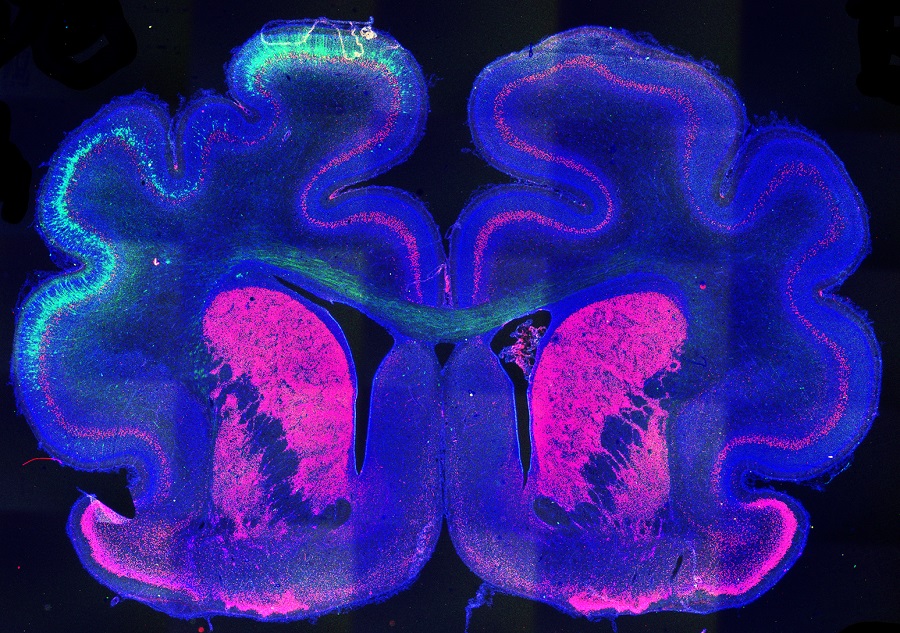
Imagen del cerebro de un hurón que muestra el patrón de plegamiento alterado (izquierda) por mediación de la proteína Cux2.
Estos resultados revelan el papel clave de Cux2 en el plegamiento: “Sabemos que para que se formen los pliegues tienen que ocurrir multitud de procesos y, tras realizar este estudio, hemos determinado que Cux2 es un factor maestro que tiene la capacidad de aprovechar el paisaje epigenético para que se produzcan los cambios que llevan a la expresión miles de genes que hacen cosas diferentes y que la combinación de todo ello hace posible que se formen los pliegues”, explica Borrell.
Mediante el análisis de células únicas (single-cell sequencing) los investigadores pudieron analizar los cambios que Cux2 causan en las células para que se generen los giros. Comprobaron que hay un tipo de Células de Glía Radial, las células madre que se encargan de generar neuronas, que prácticamente desaparece, causando que otros tipos de Células de Glía Radial proliferen en mayor cantidad. Esto no solo afecta al tipo de progenitor que da lugar a las neuronas, sino también al linaje celular que siguen las mismas, lo cual a su vez, está directamente implicado con el desarrollo de giros y surcos en el cerebro.
El plegamiento es una característica del cerebro humano que, cuando es defectuoso, conlleva graves problemas de aprendizaje e intelectuales. En ocasiones los pacientes tienen mutaciones genéticas que causan malformaciones en su cerebro por falta de giros. En esta línea Borrell destaca que realizar investigación básica “es fundamental para conocer la biología que hay detrás de estas enfermedades y nos permite estar un poco más cerca de encontrar posibles soluciones”.
Este trabajo ha sido posible gracias a la financiación del Consejo Europeo de Investigación (ERC) en el marco del programa Horizon Europe de la Unión Europea, la Agencia Estatal de Investigación – Ministerio de Ciencia, Innovación y Universidades a través de los programas de proyectos de Generación de conocimiento, FPI y Juan de la Cierva, el programa Severo Ochoa para centros de excelencia, la Fundación “La Caixa”, la Sociedad Alemana de Investigación (Deutsche Forschungsgemeinschaft), la Fundación Novo Nordisk y la Fundación Nacional Danesa de Investigación (DNRF).
Se trata de una investigación que forma parte del proyecto UNFOLD ‘Desplegando la interacción dinámica entre procesos mecánicos y moleculares en el plegamiento cerebral’ (ERC-2023-SyG n°101118729), cuyo objetivo es estudiar el plegamiento cortical desde el punto de vista de la mecánica, la biología celular y la genética.
Fuente: Instituto de Neurociencias CSIC-UMH (in.comunicacion@umh.es)


 English
English