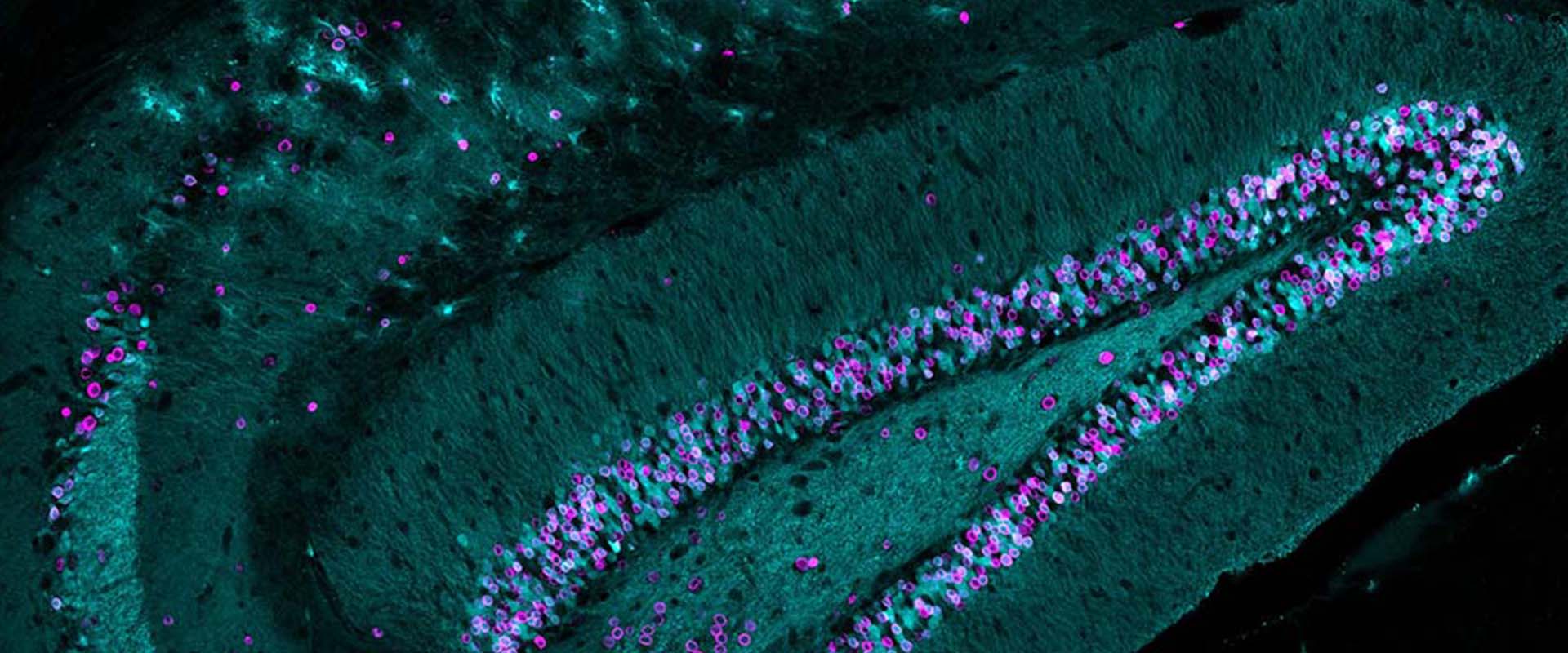
CBP and SRF co-regulate dendritic growth and synaptic maturation
El desarrollo y refinamiento de los circuitos cerebrales dependen de la acción de una red de factores de transcripción y reguladores epigenéticos que controlan la diferenciación y maduración neuronal. Uno de dichos factores es la proteína de unión a CREB (CBP), una acetiltransferasa de lisinas y co-activador transcripcional. Estudios en ratón han demostrado que la eliminación de CBP bloquea el desarrollo temprano del sistema nervioso, aunque aún se desconocen los programas de expresión génica regulados por CBP, tanto en estadios tempranos de diferenciación como en estadios más tardíos de maduración neuronal.
En este estudio, investigamos las consecuencias de la eliminación selectiva de CBP durante los últimos pasos de la diferenciación neuronal. Los ratones en los que se elimina CBP en neuronas jóvenes durante el desarrollo embrionario muestran muerte perinatal causada por una inervación defectuosa del diafragma. Además, cuando se elimina CBP en neuronas jóvenes nacidas en el cerebro de animales adultos también se observa un crecimiento y maduración anormal de dichas neuronas. De acuerdo con estos resultados in vivo, los cultivos de neuronas en los que se elimina CBP presentan proyecciones más cortas, espinas inmaduras y una respuesta deficiente a estímulos. Estos defectos coinciden con una transcripción deficiente de genes implicados en crecimiento neuronal y plasticidad, incluyendo muchas dianas comunes de CBP y del factor de respuesta al suero (SRF), un factor de transcripción regulado por actividad e involucrado en plasticidad estructural. Apoyando la relevancia de la interacción entre CBP y SRF en maduración neuronal, experimentos en los que aumentamos la actividad de SRF de una manera independiente de CBP revelan una mejora de los defectos transcripcionales y de crecimiento.
En resumen, nuestro estudio demuestra que la proteína CBP desempeña un papel esencial en la puesta en marcha de los programas genéticos que subyacen a la diferenciación neuronal y subraya la relevancia de las interacciones entre CBP y SRF durante el crecimiento neuronal y la maduración sináptica. Nuestro estudio también contribuye a aclarar la etiología del síndrome de Rubinstein-Taybi (un raro trastorno del desarrollo del sistema nervioso causado por la mutación del gen que codifica CBP), abriendo nuevas vías para la intervención terapéutica.
El trabajo ha sido realizado por el equipo del Prof. Ángel Barco en el Instituto de Neurociencias (CSIC-UMH) de Alicante y cuenta con la colaboración de investigadores del grupo de la Dra. Herrera en el mismo Instituto y de una investigadora visitante de IRCCS Humanitas (Milán, Italia).


 English
English