Alternative splicing controls pan-neuronal homeobox gene expression
Un estudio del Instituto de Neurociencias CSIC-UMH revela un mecanismo clave para controlar la actividad de reguladores de la identidad neuronal.
• Los resultados de este trabajo revelan cómo un factor esencial para la identidad neuronal es regulado por un mecanismo de splicing alternativo.
• El estudio, publicado en Genes & Development, identifica a UNC-75/CELF como el factor conservado indispensable que regula este proceso.
(Foto: José Ignacio Jordá Llorens, Eduardo Leyva Díaz y Jessica Valdivia García, investigadores del IN CSIC-UMH)
Un equipo de investigadores del Instituto de Neurociencias, centro mixto del Consejo Superior de Investigaciones Científicas (CSIC) y la Universidad Miguel Hernández (UMH) de Elche, en colaboración con investigadores de la Universidad de Columbia (Nueva York, EE.UU.), ha identificado un mecanismo que regula la producción de dos proteínas diferentes a partir de un mismo gen. Este descubrimiento, publicado recientemente en la revista Genes & Development, se ha llevado a cabo en el nemátodo C. elegans, un pequeño gusano utilizado ampliamente en la investigación biológica como modelo animal. Este hallazgo tiene implicaciones para la comprensión de la identidad neuronal en vertebrados, ya que muchos de los mecanismos descubiertos en este modelo están también presentes en ratones, humanos y otras especies.
El estudio, liderado por el investigador Eduardo Leyva Díaz, responsable de la línea emergente Mecanismos moleculares de la identidad neuronal en el IN, revela que el gen ceh-44 (homólogo del gen CUX1 en humanos y ratones) da lugar a dos isoformas completamente distintas. Una de ellas actúa como un factor de transcripción esencial para la regulación de genes neuronales, mientras que la otra codifica una proteína transmembrana localizada en el aparato de Golgi, cuya función es todavía desconocida. “Lo más sorprendente es que esta organización génica se mantiene en vertebrados, lo que sugiere que podría desempeñar un papel fundamental en la especificación neuronal en especies más complejas”, explica Leyva Díaz.
La identidad de una célula determina su morfología y funciones durante su vida. En el caso de las neuronas, su estructura es particularmente singular, ya que, una vez formadas durante el desarrollo, nunca vuelven a dividirse. Esto implica que su función debe mantenerse de forma estable a lo largo de toda su existencia. Para lograrlo, las neuronas expresan un conjunto específico de genes que definen su actividad dentro de los circuitos cerebrales. Cualquier alteración en este proceso puede comprometer su función y contribuir al desarrollo de trastornos neurológicos.
Este trabajo arroja luz sobre cómo la identidad neuronal se establece y se mantiene mediante un mecanismo de splicing alternativo. El splicing es un proceso esencial en la expresión de los genes, mediante el que se eliminan fragmentos no codificantes del ARN mensajero para generar proteínas funcionales. En algunos casos, este proceso permite que un mismo gen dé lugar a proteínas diferentes, dependiendo de cómo se ensamblen los fragmentos codificantes de ARN.
El equipo ha identificado que la producción de la versión neuronal de la proteína CEH-44 depende de un factor de splicing conservado, llamado UNC-75 en C. elegans y CELF en vertebrados. Este mecanismo es clave en la identidad neuronal porque permite la producción selectiva de proteínas específicas en el sistema nervioso. “Hemos podido demostrar que UNC-75/CELF actúa como un regulador fundamental de este proceso, promoviendo la producción de la isoforma neuronal y suprimiendo la alternativa no neuronal”, explica Leyva Díaz.
Un gusano clave para entender el cerebro
Para desarrollar esta investigación, los expertos emplearon el modelo animal C. elegans, un pequeño nematodo ampliamente utilizado en biología debido a su sencillez genética y su rápido ciclo de vida. A pesar de su aparente simplicidad, este gusano posee un sistema nervioso bien caracterizado con 302 neuronas, cuyo desarrollo y conexiones sinápticas han sido mapeados en detalle. “Trabajar con C. elegans nos permite realizar modificaciones genéticas precisas de forma rápida y reproducible, lo que facilita la identificación de mecanismos conservados en la regulación de la identidad neuronal”, señala Leyva Díaz.
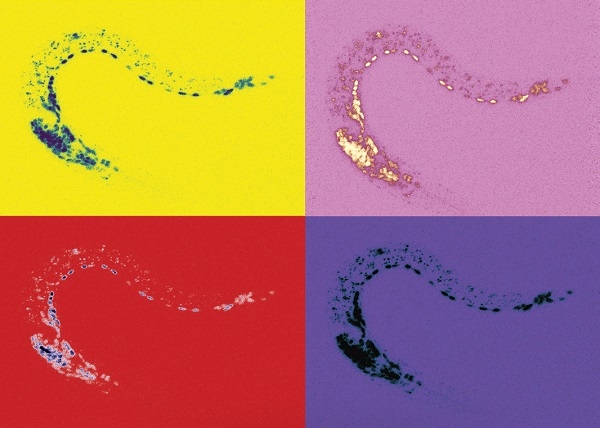
Gusano transgénico en el que el factor de splicing UNC-75, marcado con el fluoróforo mScarlet, revela su expresión en todo el sistema nervioso. El gusano fue generado mediante edición genética con la tecnología CRISPR-Cas9. Fuente: Genes & Development.
Además, su transparencia permite visualizar la expresión de genes en organismos vivos mediante técnicas de fluorescencia, lo que ha sido clave en este estudio. El equipo, que contó con la colaboración del laboratorio que el experto en mecanismos de especificación neuronal Oliver Hobert dirige en la Universidad de Columbia (Nueva York, EE.UU.), empleó herramientas de edición genética basadas en CRISPR-Cas9 y técnicas avanzadas de microscopía para caracterizar el mecanismo.
Los resultados del estudio abren nuevas vías de investigación en neurociencia del desarrollo. El siguiente objetivo del equipo es determinar si este mecanismo de splicing se mantiene en vertebrados y cómo puede afectar a la formación de circuitos neuronales en el cerebro: “Sabemos que CUX1 en humanos es esencial para la especificación de neuronas en las capas superiores de la corteza cerebral y para la formación del cuerpo calloso, pero aún desconocemos cómo se regula su expresión”, señala Leyva Díaz. En esta línea, el investigador destaca que comprender cómo se genera y mantiene la identidad de las neuronas es “crucial para descifrar el desarrollo del sistema nervioso y podría tener implicaciones en patologías donde esta identidad se pierde”.
Este trabajo ha sido posible gracias a la financiación del Instituto Médico Howard Hughes (Maryland, EE.UU.) y del programa GenT para la Contratación de Investigadores Doctores de Excelencia de la Generalitat Valenciana. El equipo agradece a la investigadora del Instituto de Neurociencias Guillermina López Bendito por acogerlo en su laboratorio, brindando un entorno idóneo para el desarrollo de esta investigación.
Fuente: Instituto de Neurociencias CSIC-UMH (in.comunicacion@umh.es)


 English
English
