Líneas de investigación
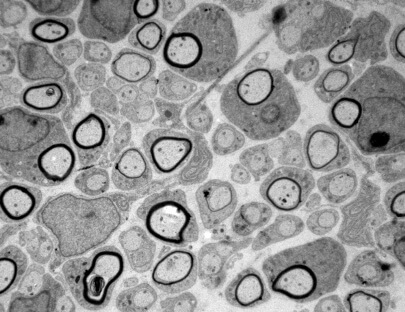
La velocidad de propagación del impulso nervioso es inversamente proporcional a la resistencia eléctrica del axón y a la capacitancia del la membrana plasmática que lo rodea. Para aumentar la velocidad del impulso nervioso, algunos invertebrados (como los calamares) han disminuido la resistencia del axón aumentando enormemente su diámetro. En sistemas nerviosos más complejos, como el de los vertebrados superiores, esto supondría incrementar en más de cien veces el volumen de su sistema nervioso, lo que resulta totalmente inviable. Para aumentar la velocidad de conducción nerviosa sin modificar el diámetro axonal es necesario disminuir la capacitancia incrementando el grosor de la membrana lipídica que rodea al axón. Esto lo han conseguido los vertebrados mediante el depósito de grandes cantidades de membrana plasmática hipertrofiada de células vecinas especializadas (oligodendrocitos o células de Schwann). Esta membrana, descrita por Rudolf Virchow en 1854, recibe el nombre de mielina. Recientemente se ha establecido que la decisión de si un axón será o no “mielinizado” y cual será el grosor de su capa de mielina depende de los niveles que este expresa de un tipo particular de proteína de la familia de las neuregulinas.
En nuestro grupo tratamos de esclarecer los mecanismos moleculares que controlan la mielinización axonal. Nuestra meta es poder utilizar esta información para desarrollar estrategias novedosas en el tratamiento de enfermedades desmielinizantes, como por ejemplo la esclerosis múltiple o la enfermedad de Canavan en el sistema nervioso central, y la enfermedad de Charcot-Marie-Tooth en el periférico. También utilizamos esta información para tratar de mejorar la regeneración de los nervios tras las lesiones traumáticas. Con el objeto de conseguir nuestros objetivos aprovechamos las aproximaciones más novedosas de la genómica como la secuenciación “masiva” del ADN de pacientes, y la modificación de genes, desarrollando modelos animales de estas enfermedades mediante la producción de knock-outs condicionales y el uso de la tecnología CRISPR/CAS9.
Publicaciones relevantes
- Schwann cell JUN expression worsens motor performance in an amyotrophic lateral sclerosis mouse model. Sonia Cabeza-Fernández, Rubí Hernández-Rojas, Angeles Casillas-Bajo, Nikiben Patel, Alerie G de la Fuente , Hugo Cabedo , Jose A Gomez-Sanchez Glia. 2024 2024 Aug 16. Online ahead of print. https://doi.org/10.1002/glia.24604
- Glial cell alterations in diabetes-induced neurodegeneration. Llorián-Salvador, M., Cabeza-Fernández, S., Gomez-Sanchez, J.A, de la Fuente A. Cell. Mol. Life Sci. 2024 81: 47 https://doi.org/10.1007/s00018-023-05024-y
- SARM1 detection in myelinating glia: sarm1/Sarm1 is dispensable for PNS and CNS myelination in zebrafish and mice. Fazal SV, Mutschler C, Chen CZ, Turmaine M, Chen CY, Hsueh YP, Ibañez-Grau A, Loreto A, Casillas-Bajo A, Cabedo H, Franklin RJM, Barker RA, Monk KR, Steventon BJ, Coleman MP, Gomez-Sanchez JA, Arthur-Farraj P. Front Cell Neurosci. 2023 17: 1158388 . eCollection 2023. PMID: 370919 https://doi.org/10.3389/fncel.2023.1158388
- A genetic compensatory mechanism regulated by Jun and Mef2d modulates the expression of distinct class IIa Hdacs to ensure peripheral nerve myelination and repair Velasco-Aviles S, Patel N, Casillas-Bajo A, Frutos-Rincón L, Velasco E, Gallar J, Arthur-Farraj P, Gomez-Sanchez JA, Cabedo H eLife 2022 11:e72917 https://doi.org/10.7554/eLife.72917
- Failures of nerve regeneration caused by aging or chronic denervation are rescued by restoring Schwann cell c-Jun Wagstaff LJ, Gomez-Sanchez JA, Fazal SV, Otto GW, Kilpatrick AM, Michael K, Wong LY, Ma KH, Turmaine M, Svaren J, Gordon T, Arthur-Farraj P, Velasco-Aviles S, Cabedo H, Benito C, Mirsky R, Jessen KR eLife 2021 10:e62232 https://doi.org/10.7554/eLife.62232
- Novel EGR2 variant that associates with Charcot-Marie-Tooth disease when combined with lipopolysaccharide-induced TNF-alpha factor T49M polymorphism Blanco-Cantó ME, Patel N, Velasco-Aviles S, Casillas-Bajo A, Salas-Felipe J, García-Escrivá A, Díaz-Marín C, Cabedo H Neurol Genet 2020 6(2):e407 https://doi.org/10.1212/NXG.0000000000000407
- Class IIa HDACs in myelination Velasco-Aviles S, Gomez-Sanchez JA, Cabedo H Aging-US 2018 10(5):853 https://doi.org/10.18632/aging.101443
- Class IIa histone deacetylases link cAMP signaling to the myelin transcriptional program of Schwann cells Gomis-Coloma C, Velasco-Aviles S, Gomez-Sanchez JA, Casillas-Bajo A, Backs J, Cabedo H J Cell Biol 2018 217(4):1249 https://doi.org/10.1083/jcb.201611150
- Schwann cell JUN expression worsens motor performance in an amyotrophic lateral sclerosis mouse model. Sonia Cabeza-Fernández, Rubí Hernández-Rojas, Angeles Casillas-Bajo, Nikiben Patel, Alerie G de la Fuente , Hugo Cabedo , Jose A Gomez-Sanchez Glia. 2024 2024 Aug 16. Online ahead of print. https://doi.org/10.1002/glia.24604
- Glial cell alterations in diabetes-induced neurodegeneration. Llorián-Salvador, M., Cabeza-Fernández, S., Gomez-Sanchez, J.A, de la Fuente A. Cell. Mol. Life Sci. 2024 81: 47 https://doi.org/10.1007/s00018-023-05024-y
- Regulatory T cells limit age-associated retinal inflammation and neurodegeneration. María Llorián-Salvador, Alerie G. de la Fuente, Christopher E. McMurran, Amy Dashwood, James Dooley, Adrian Liston, Rosana Penalva, Yvonne Dombrowski, Alan W. Stitt & Denise C. Fitzgerald. Molecular Neurodegeneration. 2024 19: 32 (2024) https://doi.org/10.1186/s13024-024-00724-w
- SARM1 detection in myelinating glia: sarm1/Sarm1 is dispensable for PNS and CNS myelination in zebrafish and mice. Fazal SV, Mutschler C, Chen CZ, Turmaine M, Chen CY, Hsueh YP, Ibañez-Grau A, Loreto A, Casillas-Bajo A, Cabedo H, Franklin RJM, Barker RA, Monk KR, Steventon BJ, Coleman MP, Gomez-Sanchez JA, Arthur-Farraj P. Front Cell Neurosci. 2023 17: 1158388 . eCollection 2023. PMID: 370919 https://doi.org/10.3389/fncel.2023.1158388
- A genetic compensatory mechanism regulated by Jun and Mef2d modulates the expression of distinct class IIa Hdacs to ensure peripheral nerve myelination and repair Velasco-Aviles S, Patel N, Casillas-Bajo A, Frutos-Rincón L, Velasco E, Gallar J, Arthur-Farraj P, Gomez-Sanchez JA, Cabedo H eLife 2022 11:e72917 https://doi.org/10.7554/eLife.72917
- Emerging Role of HDACs in Regeneration and Ageing in the Peripheral Nervous System: Repair Schwann Cells as Pivotal Targets. Gomez-Sanchez JA, Patel N, Martirena F, Fazal SV, Mutschler C, Cabedo H. Int J Mol Sci. 2022 23(6): art 2996 - Review https://doi.org/10.3390/ijms23062996
- Fasciclin 2 engages EGFR in an auto-stimulatory loop to promote imaginal disc cell proliferation in Drosophila. Velasquez E, Gomez-Sanchez JA, Donier E, Grijota-Martinez C, Cabedo H, Garcia-Alonso L PLoS Genet. 2022 18(6): art. e1010224 https://doi.org/10.1371/journal.pgen.1010224
- Failures of nerve regeneration caused by aging or chronic denervation are rescued by restoring Schwann cell c-Jun Wagstaff LJ, Gomez-Sanchez JA, Fazal SV, Otto GW, Kilpatrick AM, Michael K, Wong LY, Ma KH, Turmaine M, Svaren J, Gordon T, Arthur-Farraj P, Velasco-Aviles S, Cabedo H, Benito C, Mirsky R, Jessen KR eLife 2021 10:e62232 https://doi.org/10.7554/eLife.62232
- Novel EGR2 variant that associates with Charcot-Marie-Tooth disease when combined with lipopolysaccharide-induced TNF-alpha factor T49M polymorphism Blanco-Cantó ME, Patel N, Velasco-Aviles S, Casillas-Bajo A, Salas-Felipe J, García-Escrivá A, Díaz-Marín C, Cabedo H Neurol Genet 2020 6(2):e407 https://doi.org/10.1212/NXG.0000000000000407
- Class IIa HDACs in myelination Velasco-Aviles S, Gomez-Sanchez JA, Cabedo H Aging-US 2018 10(5):853 https://doi.org/10.18632/aging.101443
- Class IIa histone deacetylases link cAMP signaling to the myelin transcriptional program of Schwann cells Gomis-Coloma C, Velasco-Aviles S, Gomez-Sanchez JA, Casillas-Bajo A, Backs J, Cabedo H J Cell Biol 2018 217(4):1249 https://doi.org/10.1083/jcb.201611150
- Epigenetic induction of the Ink4a/Arf locus prevents Schwann cell overproliferation during nerve regeneration and after tumorigenic challenge Gomez-Sanchez JA, Gomis-Coloma C, Morenilla-Palao C, Peiro G, Serra E, Serrano M, Cabedo H Brain 2013 136:2262 https://doi.org/10.1093/brain/awt130

 English
English