En el Instituto de Neurociencias, nuestro Servicio de Microscopía pone a tu disposición una infraestructura de última generación, diseñada para dar un soporte avanzado en técnicas de microscopía y análisis de imagen.
Nuestra plataforma cuenta con equipamiento tecnológico de vanguardia, incluyendo:
- Microscopía widefield: Ideal para la observación rápida de células y tejidos.
- Microscopía confocal: Perfecta para imágenes de alta resolución.
- Microscopía multifotón: Permite la visualización de tejidos profundos.
- Light sheet: Ideal para la observación de muestras vivas o clarificadas.
Además, disponemos de estaciones de trabajo de alto rendimiento y software científico avanzado que facilitan el procesamiento y análisis de imágenes, apoyando así la investigación de vanguardia en neurociencias y campos afines.
Oferta tecnológica del servicio de microscopía





Nuestros servicios:
- Administración y supervisión: garantizamos la eficiencia en las operaciones diarias para ofrecer un servicio de calidad.
- Asesoramiento en diseño y optimización de protocolos experimentales: adaptamos los procedimientos a tus necesidades para asegurar resultados válidos y reproducibles.
- Selección y adquisición de equipamiento: asesoramos en la adquisición de nuevos equipos y en la redacción de memorias justificativas para convocatorias de financiamiento, además de colaborar con la industria para establecer colaboraciones y promover nuevas tecnologías.
- Capacitación y formación a usuarios: ofrecemos sesiones teóricas y prácticas para que domines el manejo de los equipos, las técnicas y el análisis de datos.
- Asistencia técnica: te apoyamos en la interpretación de resultados, la selección de tecnologías adecuadas y la resolución de incidencias.
- Mantenimiento, calibración y actualización tecnológica: realizamos revisiones periódicas, calibraciones y mejoras continuas en toda nuestra infraestructura.
- Elaboración de documentación y materiales de apoyo: creamos manuales, guías, informes y materiales para publicaciones científicas, además de gestionar el contenido web y la intranet del servicio.
- Organización de actividades divulgativas y formativas: organizamos workshops, seminarios, cursos y actividades para promover la difusión de tecnologías y conocimientos en microscopía.
- Control de calidad: implementamos protocolos que aseguran la validez, reproducibilidad y calidad de tus resultados.
- Colaboración con la industria: establecemos relaciones con empresas y organizaciones para demostraciones, promoción de nuevas tecnologías y colaboración en proyectos de interés.
Solicitud de formación
Rellenar el siguiente formulario para realizar una petición de formación al Servicio de Microscopía:
Solicitud Servicio Técnico Leica
Rellene el siguiente formulario para realizar una petición de Servicio Técnico de Leica:
Solicitud Servicio
Las consultas, comunicaciones y petición de citas se realizarán por correo electrónico a microscopia@umh.es
Consultar el documento «Directrices y Equipos del Servico de Microscopía» que se encuentra en el apartado ARCHIVOS para una descripción más completa de los equipos.
Microscopios multifotón (Lab 020)

Microscopio multifotón Leica SP5 vertical, con equipamiento necesario para experimentos de imagen in vivo e in vitro combinados con registros electrofisiológicos. Dispone de láser infrarrojo MaiTaiHP DeepSee sintonizable de 690nm a 1040nm y detectores híbridos externos de alta sensibilidad para adquisición en multifotón. Con láser argón multilínea (458, 476, 488, 496 y 515nm), diodo 561nm y láser 633nm para adquisición en modo confocal. Los objetivos más utilizados son 5x seco, 25x y 63x de inmersión en agua y larga distancia de trabajo.
Microscopios confocales (Lab 019 y 021)
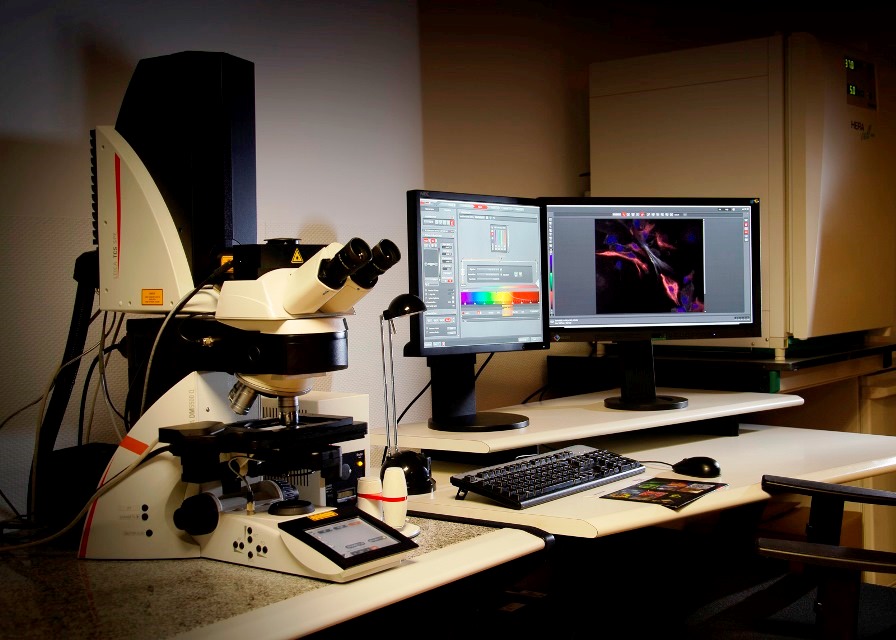
Microscopio confocal vertical Leica SPEII, Con platina motorizada para la adquisición de imágenes en mosaico y multiposición. Está equipado con cuatro láseres (405nm, 488nm, 561nm y 635nm) y cuatro objetivos (10x seco y 20x, 40x y 63x de aceite).
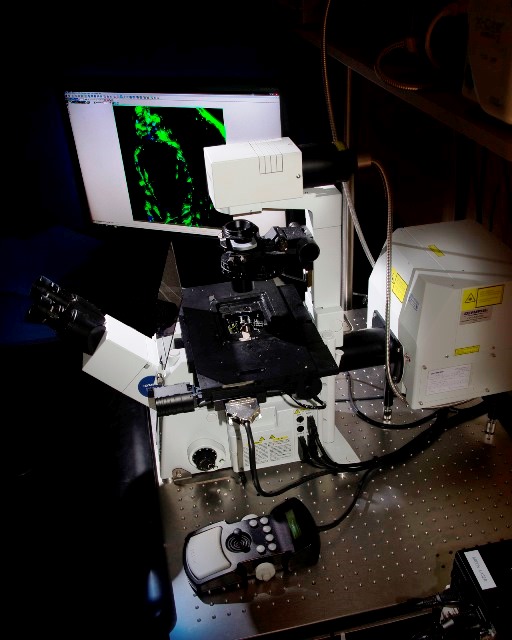
Microscopio confocal invertido Olympus FV1200, con platina motorizada XY que permite llevar a cabo experimentos de imagen en varios campos y creación de mosaicos. Está dotado de láser violeta (405nm), argón multi-línea (473, 488 y 515nm), láser 559nm y láser 635nm. Dispone de objetivos de 10x y 20x secos además de 20x, 40x y 60x de aceite.
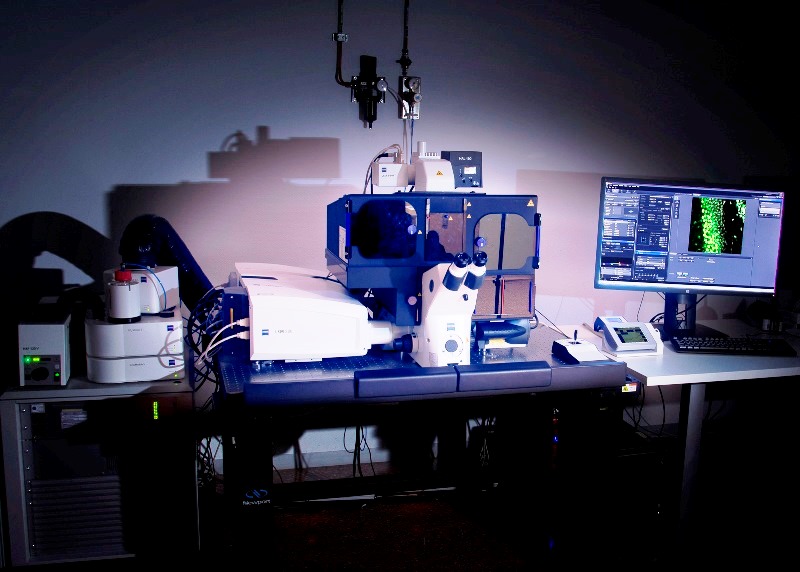
Microscopio Confocal Superresolución invertido Zeiss LSM 880-Airyscan Elyra PS.1 ,con controlador de temperatura y CO2 para la realización de experimentos de imagen multidimensional con tejido biológico fijado o vivo. Permite adquirir imágenes tanto en modo confocal como en superresolución Airyscan (140nm), iluminación estructurada SIM(100 nm) y PALM/dSTORM(20-30nm).Está equipado con dos juegos de láseres:para microscopía confocal (405, 458, 488, 514, 561 y 634nm) y súper-resolución (405, 488, 561 y 640nm).Objetivos:10x seco, 25x de multi-inmersión, 40x agua, 63x agua, 63x aceite y 100x aceite.

Confocal Spinning Disk Dragonfly: Microscopio confocal spinning disk para la captura en tiempo real de procesos dinámicos. Consta de sistema de incubación, platina motorizada, dos cámaras Andor Zyla 4.2 para adquisiciones duales simultáneas y cuatro líneas láser (405, 488, 561 y 637nm). Objetivos: 10x y 20x secos, 20x multiinmersión (aceite, glicerina y agua), 25x LWD de inmersión en agua, así como 40x y 60x de aceite.
Microscopios light sheet
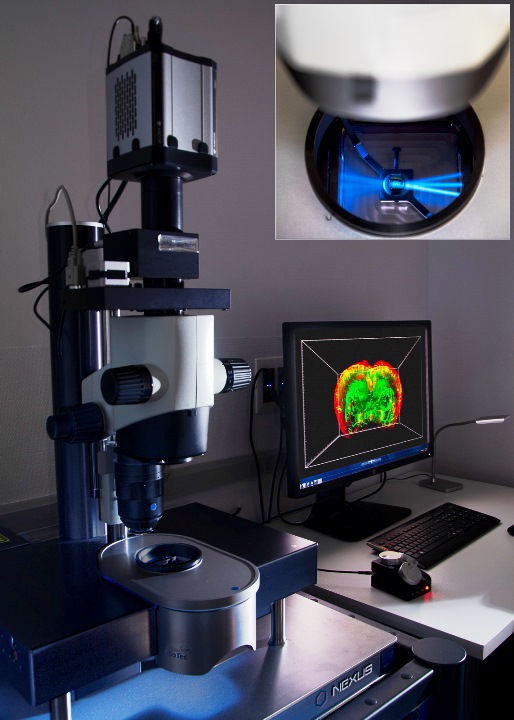
Microscopio light sheet UltramicroscopeII LaVisionBiotec, para muestras clarificadas. Tiene láseres para las líneas 488nm, 561nm y 635nm. El objetivo de adquisición es de 2x con zoom de 0.63x a 6.3x, ofreciendo magnificación dinámica desde 1.26x a 12.6x.
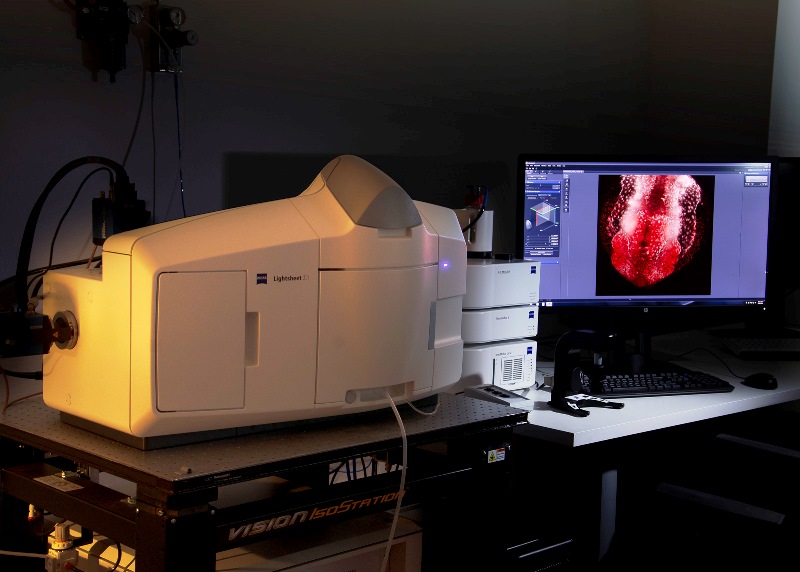
Microscopio LightsheetZ.1 Zeiss, para muestras vivas semitransparentes que permite adquisición de imágenes con rotación de 360º. Está equipado con los láseres 405nm, 488nm, 561nm y 635nm. Dispone de tres objetivos: un 5x seco y dos objetivos de inmersión en agua (10x y 20x).
Microscopios widefield
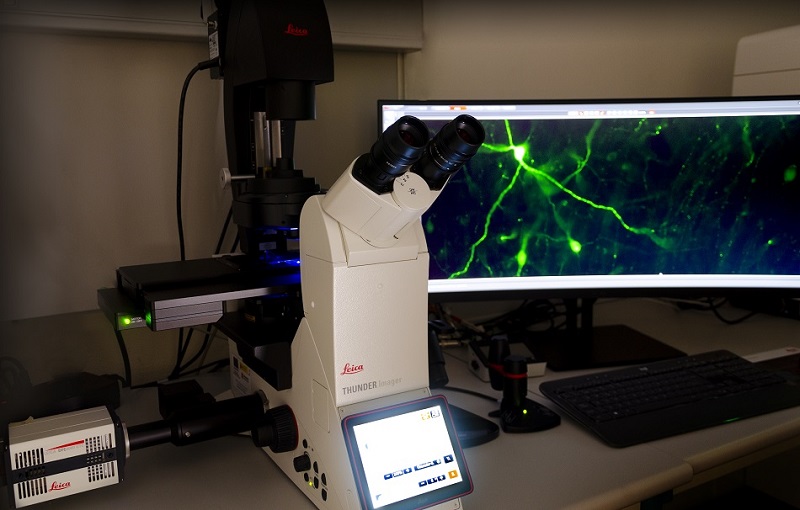
Microscopio invertido widefield completamente motorizado, para la captura de imágenes con seccionamiento óptico mediante Computational Clearing en muestras fijadas o vivas. Iluminación LED con 8 líneas de excitación desde UV a rojo lejano. Objetivos secos 5x/0.12, 10x/0.32 y 20x/0.80, y de aceite 40x/1.30 y 63x/1.40.
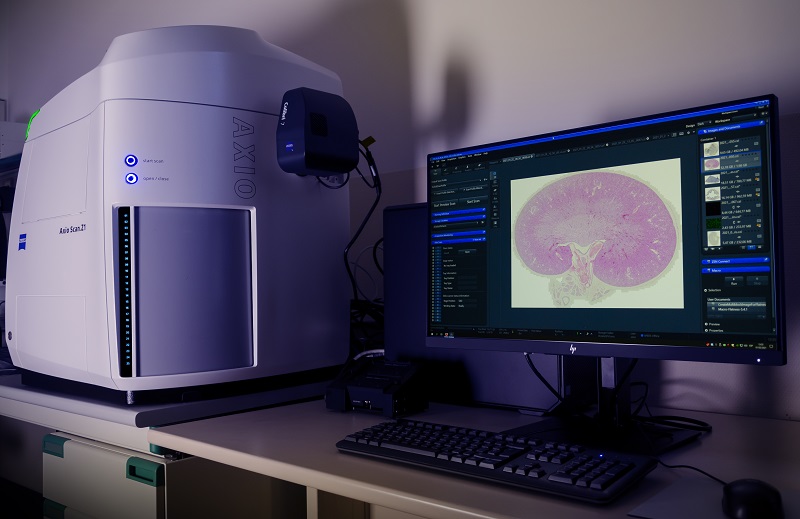
Completamente automatizado para muestras fluorescentes o de campo claro, con capacidad de hasta 100 portaobjetos. Iluminación LED con 7 líneas de excitación desde el UV al rojo lejano. Objetivos secos de 5x/0.25, 10x/0.45, 20x/0.8 y 40x/0.95.

Sistema Neurolucida , para la reconstrucción y análisis de tejido de cerebro y neuronas. Se basa en un microscopio de fluorescencia y campo claro Leica DM4000. Está equipado con filtros de fluorescencia para DAPI, GFP, Cy3 y Cy5. Tiene objetivos secos de 2.5x, 10x, 20x y 40x, así como un objetivo de inmersión en aceite de 63x. La detección puede ser a través de una cámara de color (MBF CX9000) o una cámara monocroma (QImaging).

Microscopio vertical Leica DM5000B , de fluorescencia y campo claro, para la visualización de muestras fijadas. Está equipado con filtros de fluorescencia para DAPI, GFP y Cy3. Tiene objetivos secos de 2.5x, 5x, 10x, 20x y 40x
Estereomicroscopio Leica MZFLIII
Estereomicroscopio Leica MZFLIII (Lab 021)
Estaciones de trabajo
Estación de procesamiento de alto rendimiento HIVE
Se trata de una estación de trabajo centralizada de gama alta para el procesamiento de imágenes y la computación de alto rendimiento/GPU, óptima para aplicaciones exigentes y configuraciones multiusuario. Contiene los programas ZEISS arivis Pro, Huygens Professional, FIJI, QuPath, Zen Blue (Zeiss) y Las X (Leica).
Estación de trabajo Superresolución
Zen: https://www.zeiss.com/microscopy/int/products/microscope-software/zen.html
Incluye: ZEN Black, ZEN Blue, Huygens Professional, Leica LAS X Core Widefield, Imaris Viewer y ImageJ/Fiji.
Estación de trabajo Lightsheet
Incluye: ZEN Black, ZEN Blue 3.3 Lite, Leica LAS X Core Widefield, Imaris Viewer , ImageJ/Fiji y Huygens Professional.
Estación de trabajo Imaris I
Incluye: Imaris, AutoQuant X3, Huygens Professional, ImageJ/Fiji, Olympus FV10-ASW Viewer, Leica LAS X Core, ZEN Blue 3.3 Lite de Zeiss y Terrastitcher ImspectorPro de LaVisionBiotec.
Estación de trabajo Imaris II
Incluye: Imaris, Imaris Stitcher, ImageJ/Fiji 64 bit, Olympus FV10-ASW Viewer, Leica LAS X Core, ZEN Blue 3.3 Lite de Zeiss, ClearMap y Huygens Core HRM.
Estación de trabajo
ImageJ/Fiji, Neurolúcida Explorer, Olympus FV10ASW Viewer, ZEN Blue 3.3 Lite y Leica LAS X Core.
Servidor de Almacenamiento Temporal (NAS)
Servidor NAS: Para almacenamiento temporal de archivos generados en los equipos que requieran un procesamiento posterior con software científico del Servicio de Microscopía.
Normas generales de uso
Es obligatorio que todos los usuarios conozcan y respeten las normas de funcionamiento del Servicio de Microscopía. Toda la información relevante está claramente especificada en el documento “Información General y Normas_SM”, el cual puede descargarse en la sección “ARCHIVOS” del menú lateral izquierdo. A continuación, se presentan dichas normas para su cumplimiento:
- 1. Todas las comunicaciones, consultas y peticiones se realizarán por correo electrónico a: microscopia@umh.es
- 2. El investigador principal es el responsable del uso que el personal a su cargo realiza en los equipos del Servicio de Microscopía, así como del cumplimiento de las normas.
- 3. Serán considerados usuarios del servicio todo el personal de investigación afiliado al IN y los investigadores visitantes que realicen estancias por un periodo superior a 12 meses. Estos últimos deberán acreditar experiencia comprobada en técnicas de microscopía.
- 4. Los usuarios del servicio deben solicitar su inclusión en la lista de distribución microscopia@listas.umh.es a través del siguiente enlace: https://listas.umh.es/sympa/info/in.microscopia. Por medio de esta lista se realizarán todas las comunicaciones referentes al funcionamiento del servicio.
- 5. Los estudiantes de grado o máster podrán utilizar los equipos únicamente en presencia y bajo la supervisión de un miembro del laboratorio que tenga conocimiento del funcionamiento del equipo. Además, no podrán realizar reservas a su nombre. La persona supervisora será quien lo haga.
- 6. Es obligatorio que todos los nuevos usuarios reciban una formación previa impartida por el personal del servicio antes de utilizar cualquier equipo. Asimismo, durante las sesiones iniciales, deberán estar acompañados en todo momento por el personal del servicio o por usuarios experimentados, con el fin de garantizar un uso seguro y adecuado de los equipos.
- 7. Las solicitudes de formación deberán realizarse a través del formulario habilitado en el apartado “SERVICIOS” de la página web del Servicio de Microscopía. Para que la formación sea llevada a cabo, el solicitante debe cumplir con los siguientes requisitos:
- Conocer las normas generales del Servicio de Microscopía.
- Disponer de muestras propias y contar con conocimientos específicos suficientes sobre ellas.
- Tener claridad sobre las preguntas y objetivos específicos que desea resolver con el uso del equipamiento solicitado.
- Estar en condiciones de utilizar los equipos de manera inmediata y de forma continuada.
- El personal del servicio no llevará a cabo la formación si estos requisitos no se cumplen.
- 8. Las reservas de los equipos disponibles se deben realizar a través del sistema de reserva de salas en la página web: http://in.umh-csic.es/ Para ello, ingrese a la sección «Acceso usuarios» y seleccione la opción «Reservas». Todos los recursos ofertados por el servicio llevan el prefijo “SM”.
- 9. El titular de la reserva es el responsable del estado del equipo durante ese periodo.
- 10. El último usuario reservado del día será responsable de apagar el microscopio y todos sus componentes. Se recomienda consultar la intranet para confirmar si es la última reserva del día.
- 11. Los usuarios deben comenzar y finalizar su reserva de manera puntual para no interferir en el trabajo de los compañeros.
- 12. Las reservas no utilizadas durante los primeros 15 minutos serán consideradas desiertas y podrán ser utilizadas por otros usuarios.
- 13. Para garantizar el correcto funcionamiento y la prolongación de la vida útil de los equipos de microscopía, es fundamental seguir ciertas pautas esenciales durante su uso:
- El área de trabajo debe permanecer siempre limpia, especialmente al finalizar cada sesión.
- El medio de montaje de las muestras debe estar completamente seco y los cubres sellados con laca de uñas.
- Es importante colocar correctamente el portaobjetos en la platina, para evitar el daño de los objetivos.
- En caso de utilizar objetivos de inmersión, se debe aplicar únicamente una gota de aceite sobre el cubre, evitando su aplicación excesiva.
- Se debe tener especial cuidado de no ensuciar con aceite los objetivos secos.
- Las botellas de aceite de inmersión de la mesa deben estar debidamente cerradas para evitar derrames.
- Si no está seguro de realizar alguna tarea, sin importar lo sencilla que pueda parecer, solicite ayuda al personal del servicio.
- 14. Tras el uso del microscopio se debe:
- Limpiar con cuidado los objetivos de inmersión utilizando el papel de lentes que se encuentra sobre la mesa, sin aplicar etanol. Debe dejarse colocado el objetivo de menor magnificación.
- Dejar la platina en la posición de seguridad y centrada.
- Limpiar el área de trabajo.
- Anotarse en las libretas de uso de los microscopios: fecha, nombre del usuario, extensión, horas de uso, objetivos usados y estado del equipo.
- 15. Está estrictamente prohibido navegar por internet, realizar cambios en el software y utilizar dispositivos de almacenamiento externos en todos los ordenadores del servicio.
- 16. Los usuarios son responsables de transferir las imágenes adquiridas o procesadas a los dispositivos o servidores correspondientes. Además, deben eliminar las imágenes de su carpeta personal en el disco local una vez que hayan terminado su uso.
- 17. En todos los equipos hay configurado un sistema de borrado automático de archivos. Este sistema elimina de manera periódica aquellos archivos que tengan una antigüedad superior a 30 días desde su adquisición. Una vez eliminados, los archivos no podrán ser recuperados.
- 18. Para promover un entorno de trabajo responsable y respetuoso, se establecen a continuación las sanciones que garantizan el correcto uso y mantenimiento del equipamiento del servicio de microscopía:
- Los usuarios que no sigan los procedimientos adecuados de limpieza y manejo del equipo serán informados de cómo proceder. En caso de reincidencia por parte del mismo usuario, se procederá a suspender el uso de cualquier equipo del servicio durante dos semanas.
- Los usuarios que dejen los equipos encendidos después de haber sido los últimos en utilizarlos durante el día serán sancionados con la suspensión del uso de los equipos por un mes.
- Si un estudiante de grado o máster manipula un equipo sin supervisión, no podrá usar ningún equipo durante el resto del curso académico. Además, los miembros de su laboratorio de procedencia serán sancionados y no podrán usar los equipos durante un mes.
- Los usuarios que cancelen un turno en el día en curso serán penalizados con dos semanas sin acceso a los equipos del servicio.
- Los usuarios que tengan una reserva y no ocupen su turno, no podrán utilizar los equipos del servicio durante un mes.
- En caso de reincidencia por parte del usuario en los puntos establecidos, se prohibirá el uso del servicio durante tres meses.
Las reservas de todos los equipos del servicio se realizarán a través de la intranet del Instituto de Neurociencias.
Tarifas
Nuestro Servicio de Microscopía ofrece a usuarios externos la oportunidad de acceder a nuestro avanzado equipamiento. Si no formas parte de nuestro centro, pero deseas utilizar nuestra tecnología y conocimientos para tus proyectos, no dudes en contactarnos a través del correo electrónico microscopia@umh.es
Ubicación
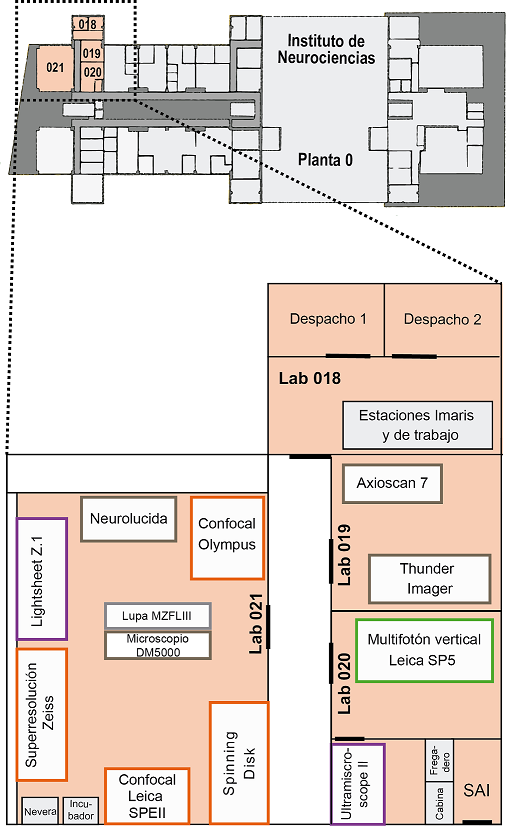
El servicio de Microscopía está situado en la zona sur de la planta baja del IN. Consta de las siguientes salas:
Sala 018
- Despacho 1: Giovanna Expósito
- Despacho 2: Almudena Íñigo
- Estación Imaris I
- Estación Imaris II
- Estación de trabajo
Sala 019
- Microscopio invertido Leica Thunder Imager
- Escáner de portaobjetos Zeiss Axioscan 7
Sala 020
- Microscopio multifotón Leica SP5 vertical
- Microscopio multifotón Leica SP2 invertido
- Microscopio lightsheet UltramicroscopeII LaVisionBiotec
Sala 021
- Microscopio confocal vertical Leica SPEII
- Microscopio confocal invertido Olympus FV1200
- Microscopio Confocal Superresolución invertido Zeiss LSM 880-Airyscan Elyra PS.1
- Workstation Superresolución
- Microscopio LightsheetZ.1 Zeiss
- Workstation Lightsheet in vivo
- Sistema Neurolucida
- Lupa de fluorescencia Leica MZFLIII
- Microscopio vertical Leica DM5000B
- Microscopio confocal spinning disk Dragonfly
Software con licencia en el servicio:
- Imaris (Bitplane): software para visualización, procesamiento, análisis y exportación de imágenes multicanal en 2D, 3D y 4D. http://www.bitplane.com/
- Zeiss arivis Pro: software para visualización, procesamiento, análisis y exportación de imágenes multicanal en 2D, 3D y 4D. https://www.arivis.com/products/pro
- Neurolucida: http://www.mbfbioscience.com/neurolucida
- Strereo Investigator: https://www.mbfbioscience.com/stereo-investigator
- Huygens Profesional: https://svi.nl/Huygens-Software
- AutoQuant X3: software de deconvolución.http://www.mediacy.com/autoquantx
Software libre para visualización y análisis de imagen:
- ImageJ: programa gratuito para el procesamiento y análisis de imágenes multidimensionales.https://imagej.nih.gov/ij/
- Fiji: es el mismo software que ImageJ, pero incluye un paquete de procesamiento muy completo para el análisis de imagen científica.https://imagej.net/Fiji
- ClearMap: software libre creado para el análisis de imagen de muestras de iDISCO+. Permite la detección de objetos en 3D y localización en núcleos cerebrales.https://idisco.info/clearmap-2/
- Zeiss: https://www.zeiss.com/microscopy/int/products/microscope-software/zen-lite.html
- Leica: https://www.leica-microsystems.com/products/microscope-software/p/leica-las-x-ls/downloads/
Tutoriales:
- Imaris: http://www.bitplane.com/learning
- Zeiss arivis Pro: https://kb.arivis.com/arivis-vision4d-video-tutorials-compendium
- ImageJ/Fiji: http://imagej.net/Category:Tutorials#Tutorials_for_new_users
- Neurolúcida: http://www.mbfbioscience.com/webinars
- Estereología: https://www.stereology.info
- Microscopía óptica: http://zeiss-campus.magnet.fsu.edu/
- Microscopía light sheet: https://www.youtube.com/watch?v=vKHQudCKVGc
- Huygens Profesional: https://svi.nl/tiki-index.php?page=IntroductionMovies
- LAS X Thunder: https://youtu.be/36HqrFyy0fQ
- LAS X Navigator: https://youtu.be/iqMgOmjslf8
- Análisis de Bioimagen: https://bioimagebook.github.io/README.html
Técnicas de clarificado:
- https://idisco.info/
- https://www.lavisionbiotec.com/products/UltraMicroscope/scanner-options.html
- http://clarityresourcecenter.org/
- https://transparent-human-embryo.com/
Ética en tratamiento de imagen digital:
Visualización de espectros:
» Microscopia de alta resolución automatizada y apoyo a manejo de datos de imagen de alta densidad para Unidad de Imagen EQC2019-006023-P. FEDER/Ministerio de Ciencia e Innovación – Agencia Estatal de Investigación.
» Actualización del Servicio de Imagen celular ECQ_2018_004690_P. FEDER/Ministerio de Ciencia e Innovación Agencia Estatal de Investigación, cofinanciado con el proyecto Severo Ochoa SEV-2017-0732.
» Actualización de Servicio de Imagen Celular CSIC15-EE-3246 FEDER/Ministerio de Economía, Industria y Competitividad, cofinanciado por el proyecto Severo Ochoa SEV-2013-0317.






Responsable científico:
Ana Carmena de la Cruz
acarmena@umh.es »
+34 965 91 9230

Técnico Superior Especializado OPIS CSIC:
Giovanna Expósito Romero
gexposito@umh.es »
+34 965 91 92 66

Técnico Superior Especializado OPIS CSIC:
Aida Giner de Gracia
aginer@umh.es
+34 965 91 92 66

Consultas, comunicaciones, petición de citas y solicitud de formación de equipos preferentemente por correo electrónico a: microscopia@umh.es
Servicio de Microscopía
Instituto de Neurociencias
Universidad Miguel Hernández – CSIC
Campus de San Juan
Sant Joan d’Alacant
Alicante | España
Tel. + 34 965 23 37 00
(ext. service 9266)
Fax + 34 965 91 95 61
Solo visible para miembros.
Acceder

 English
English