EQUIPO INVESTIGADOR
Dr. Juan Lerma (Investigador responsable del proyecto)
Dra. Sandra Jurado
Mª Isabel Aller
Julio Barbas
Amr Fawzy
Beatriz Fernández
Álvaro García
Pilar Madrigal
María Pérez
María Royo
Sergio Valbuena
Ana Valero
RESUMEN DEL PROYECTO “PAHECE”
Las modificaciones en la eficacia sináptica como consecuencia de las propiedades plásticas son el principal sustrato biológico cerebral para ajustar las capacidades de percepción, aprendizaje o construcción de recuerdos. Pequeñas alteraciones de su funcionamiento subyacen diversas disfunciones cerebrales, y constituyen la base de las deficiencias cognitivas asociadas a distintos procesos patológicos. La incorporación en la Neurociencia de técnicas de biología molecular, genética, electrofisiología o imagen, ha aumentado extraordinariamente nuestro conocimiento de los mecanismos moleculares que median la comunicación neuronal y los cambios de eficacia sináptica. Estas nuevas tecnologías indican la existencia de mecanismos de control homeostático que compensan la aparición de alteraciones transitorias en los circuitos neuronales de manera rápida y eficaz. Datos recientes han demostrado que alteraciones en la homeostasis cerebral subyacen la etiopatogenia de enfermedades neurológicas por lo que la identificación de los mecanismos básicos que la regulan es clave para el desarrollo de nuevas estrategias terapéuticas.
El fenómeno de plasticidad homeostática aparece en respuesta a pequeños desequilibrios en las redes neuronales con el fin de reponer su estado a escala global. Experimentos en neuronas en cultivo demuestran que cambios en la actividad neuronal inducen una respuesta compensatoria en sentido contrario al cambio, disminuyendo o incrementando la transmisión sináptica mediante la movilización de receptores de glutamato en las regiones de contacto sináptico. Se ha sugerido que la alteración de estos mecanismos compensatorios subyace a diversas alteraciones neurológicas, pero desafortunadamente no existen modelos experimentales que permitan estudiar la contribución de la plasticidad homeostática a los déficits cognitivos in vivo.
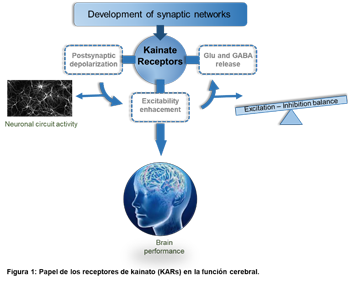
Uno de los elementos que ha cobrado importancia en las enfermedades cerebrales son los receptores de kainato (KARs), ya que pueden regular la comunicación neuronal a corto y largo plazo. Recientes avances en el nuestro laboratorio empleando una nueva línea transgénica que sobreexpresa la subunidad GluK4 de los KARs han revelado la existencia de un fenómeno sináptico que podríamos denominar anti-homeostático (Arora et al., 2018). En estos animales, en contraposición a los mecanismos clásicos de homeostasis, los contactos neuronales presentan no solo una mayor probabilidad de liberación sino además un aumento no anticipado de las respuestas elementales postsináticas. Esto sugiere una forma de compensación anti-homeostática no descrita hasta ahora y que podría ser la base de los déficits cognitivos observados en estos ratones mutantes. Estos hallazgos no solo suponen un nuevo paradigma de pensamiento en el área de la regulación sináptica, sino que proporcionan un modelo experimental adecuado para profundizar en el papel de la plasticidad homeostática in vivo.
El objetivo de este proyecto será el estudio de los mecanismos que median las distintas formas de plasticidad cerebral incluyendo el nuevo fenómeno de plasticidad anti-homeostática. Nuestro estudio combinará técnicas novedosas de electrofisiología, imagen, comportamiento y optogenética que nos permitirán entender el nuevo aspecto en la regulación de la transferencia de información en el cerebro, un conocimiento esencial para entender la etiopatogenia de diversos estados patológicos, como epilepsia, autismo o esquizofrenia.
PUBLICACIONES PROMETEO
- Royo M, Aznar-Escolano B, Madrigal P, Jurado S (2022) AMPA receptor function in the hypothalamic synapses. Frontiers in Synaptic Neuroscience. In press.
- Madrigal MP, Jurado S (2021) Specification of the oxytocinergic and vasopresinergic during the developing mouse brain. Commun Biol. 4(1):586. DOI: 10.1038/s42003-021-02110-4.
- Valbuena S, Lerma J (2021) Kainate receptors, homeostatic gatekeepers of synaptic plasticity. Neuroscience. DOI: 10.1016/j.neuroscience.2019.11.050.
- Valbuena S, Lerma J (2021) Losing balance: Kainate receptors and psychiatric disorders comorbidities. Neuropharmacology. 191:108558. doi: 10.1016/j.neuropharm.2021.108558.
- Eed A, Cerdán Cerdá A, Lerma J, De Santis S. Diffusion-weighted MRI in neurodegenerative and psychiatric animal models: Experimental strategies and main outcomes (2020) J Neurosci Methods. 2020 Sep 1;343:108814. doi: 10.1016/j.jneumeth.2020.108814.
- Valbuena S, García Á, Mazier W, Paternain AV, Lerma J (2019) Unbalanced dendritic inhibition of CA1 neurons drives spatial-memory deficits in the Ts2Cje Down syndrome model. Nature Commun 10:4991–12. DOI: 10.1038/s41467-019-13004-9.
- Møllerud S, Hansen RB, Pallesen J, Temperini P, Pasini D, Bornholt J, Nielsen B, Mamedova E, Chalupnik P, Paternain AV, Lerma J, Diaz-del-Castillo M, Andreasen JT, Frydenvang K, Kastrup JS, Johansen TN, Pickering DS (2019) N-(7-(1H-Imidazol-1-yl)-2, 3-dioxo-6-(trifluoromethyl)-3,4-dihydroquinoxalin-1(2H)-yl) benzamide, a new kainate receptor selective antagonist and analgesic: synthesis, X-ray crystallography, structure-affinity relationships, and in vitro and in vivo pharmacology. ACS Chem Neurosci 10:4685–4695. DOI: 10.1021/acschemneuro.9b00479.
- Royo M, Gutiérrez Y, Fernández-Monreal M, Gutiérrez-Eisman S, Jiménez R, Jurado S, Esteban JA (2019) A retention-release mechanism based on RAB11FIP2 for AMPA receptor synaptic delivery during long-term potentiation. J Cell Sci. 32(24). DOI: 10.1242/jcs.234237.
- Madrigal MP, Portalés A, SanJuan MP, Jurado S (2019) Postsynaptic SNARE Proteins: Role in Synaptic Transmission and Plasticity. Neuroscience. 420:12-21. DOI: 10.1016/j.neuroscience.2018.11.012.
- Arora V, Pecoraro V, Aller MI, Román C, Paternain AV, Lerma J (2018) Increased Grik4 Gene Dosage Causes Imbalanced Circuit Output and Human Disease-Related Behaviors. Cell Rep. 23(13):3827-3838. DOI: 10.1016/j.celrep.2018.05.086.
- Simões AP, Silva CG, Marques JM, Pochmann D, Porciúncula LO, Ferreira S, Oses JP, Beleza RO, Real JI, Köfalvi A, Bahr BA, Lerma J, Cunha RA, Rodrigues RJ (2018) Glutamate-induced and NMDA receptor-mediated neurodegeneration entails P2Y1 receptor activation. Cell Death Dis. 9(3):297. doi: 10.1038/s41419-018-0351-1.

 Español
Español